近年来,随着纳米医学的发展,将纳米材料应用于肿瘤靶向药物递送有望改善化疗效果。纳米药物递送系统能增加药物溶解性、改变药物体内分布、提高药物靶向性,从而提高治疗效果,降低不良反应发生率,成为肿瘤靶向治疗的研宄热点。
随着纳米技术的发展,纳米材料因其小尺寸效应、体积效应、表面效应和量子效应的独特优势被广泛应用于药物递送体系。由于EPR效应,纳米材料能够大量聚集在肿瘤部位从而提高肿瘤的治疗效果,降低毒副作用。同时,纳米材料由于其自身的声、电、光、磁、热等理化性质,能够通过功能化实现药物靶向运输和肿瘤联合治疗等,对提高肿瘤治疗效率具有重要的意义。
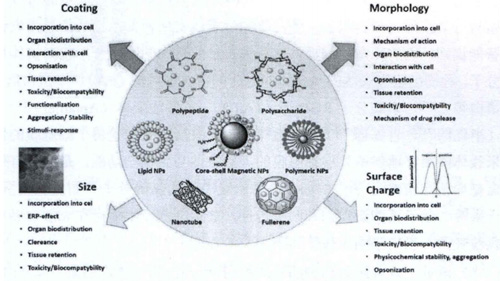
图 在药物输送系统中,不同纳米药物载体的物理化学特征
其中,使用功能性纳米载体进行治疗剂靶向递送的系统,我们称之为纳米药物递送系统(nano-drug delivery system,NDDS)。纳米载药系统的出现和发展,将极大的促进化疗药物在肿瘤治疗中的应用。相较于传统抗癌药物,纳米药物递送体系主要有以下几大优势:
(1) 纳米药物载体可增加药物的可溶性,提高药物稳定性,从而减少药物用量,提高药物疗效。
纳米载体具有尺寸小,比表面积大,形貌可控,易于修饰等优点,能有效包埋、吸附或共价交联亲/疏水药物分子,使化疗药物在载体中形成较高的局部浓度。此外,纳米材药物载体能够为药物分子提供一个稳定和隐蔽的储存空间,在药物传输过程中能有效避免药物在人体生理环境的作用下发生降解和失活等现象,从而维持药物的活性。这有利于提高抗癌药物在病灶部位的浓度、减少给药次数,降低细胞产生“耐药性”的几率进而提高肿瘤治疗效果。同时,同一个纳米药物载体可以装载两种或多种药物,达到协同高效治疗的目的。
(2) 纳米药物载体通过主动/被动靶向可实现精准治疗。
纳米药物递送体系本身具有独特的尺寸效应,还可以对其功能化修饰,从而实现对病灶部位的靶向聚集,提高药物治疗效果,减小对正常组织和细胞的毒副作用。纳米药物递送体系的靶向性传递包括被动靶向和主动靶向两种方式,被动靶向即纳米递送体系通过肿瘤组织EPR效应优先富集到肿瘤组织的过程;主动靶向即纳米输送体系通过偶联特异性配体或抗体成分,与细胞表面特异受体结合,从而实现在靶向组织的积累。肿瘤细胞可以无限增殖与一些基因、细胞因子及蛋白质的过表达密切相关,这些信息为设计含有智能识别位点的靶向药物提供了依据,目前常用的靶向分子包括抗体片段及分子,肿瘤细胞高表达的与受体相对应的配体如叶酸(FA)、蛋白质(转铁蛋白等)、多肽分子RGD、TAT、核酸适配体(Aptamer)、多糖(半乳糖、甘露糖)等。近年来,新发展起来的包覆了细胞膜的仿生纳米载体能很好地保留外层细胞膜的天然特性与生物学功能,是一种有效的肿瘤靶向治疗策略例如,癌细胞膜表面的黏附分子(如黏着斑蛋白、整合素等)赋予其同源识别和归巢特性,故癌细胞膜常被用作壳层包裹在纳米颗粒表面,以增强纳米载体的靶向及内吞能力。
(3)降低生理屏障对药物的阻碍作用,提高药物在体内的血液循环时间。药物分子在到达其作用位点前需经历血液屏障、组织屏障、细胞屏障以及胞内转运屏障等一系列生理屏障。例如,纳米药物递送系统通过静脉给药进入血液循环后,肝、脾等脏器的网状细胞和血管的内皮细胞能够借助伪足吞噬体内的异物。这些吞噬能力极强的细胞统称为单核吞噬细胞系统(Mononuclear phagocyte system,MPS)又称网状内皮系统((Reticuloendothelial system,RES)。大量研宄表明,对纳米粒子的表面特征进行改性,如聚乙二醇修饰,构建仿生递送系统,活细胞作为药物载体等,可制成“隐形”纳米颗粒,阻碍RES系统吞噬,克服此屏障。而当药物进入组织后,需要穿越质膜,到达细胞内的作用位点,而在这一过程中,生物大分子药物一般不能通过渗透作用穿过细胞膜。纳米药物载体的尺寸一般在10-1000nm之间,其尺寸与蛋白质、核酸等生物大分子相近,同时又远远小于细胞和各种细胞器的尺寸,因此更容易携带各种生物大分子或药物进入细胞或细胞器。当纳米药物载体经过内吞途径进入病变组织细胞后,内涵体/溶酶体是细胞内递送的较主要屏障。对于作用靶点在细胞核的药物而言,内涵体/溶酶体中的酸性环境和多种酶的存在易使药物降解或失活。而对纳米载体进行功能化修饰,通过质子海绵效应等使溶酶体膜破坏、去稳定化或膜融合,可以实现载体和药物的内涵体/溶酶体逃逸
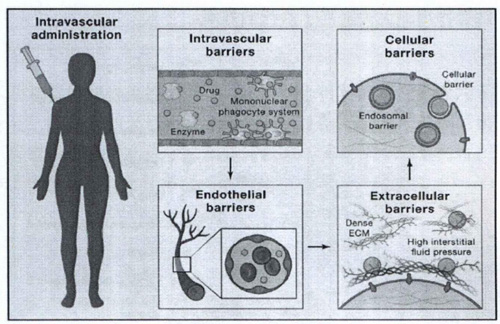
图 纳米药物递送系统在人体内会遇到一系列的生物屏障
(4)纳米药物载体为发展剌激响应型的智能纳米给药系统提供了契机。
由于纳米材料自身结构和组成的多样性,且容易功能化修饰等优点,因此我们可以根据病变部位一些特殊的物理化学特征,设计刺激响应型的纳米材料来实现药物的响应性靶向释放。具有剌激响应性的纳米药物载体的设计主要有两种方式:一种是纳米载体本身具有刺激响应性,例如具有pH响应性的聚合物纳米颗粒、骨架中掺杂易被GSH还原的二硫键/二硒键的纳米颗粒、蛋白酶可降解的纳米凝胶等,它们在外界信号刺激下会产生物理或化学变化,如分子链结构、溶胀、溶解性以及解离等行为,从而释放药物。另外一种是将刺激响应性基团或分子修饰在纳米颗粒的内外表面,利用修饰基团与药物间的可逆性结合或者对颗粒设立“门控”分子,赋予药物在不同刺激下的可控释放。这些刺激信号主要包括内源性刺激,如pH、GSH、酶和其他生物内源性物质等化学信号,以及外源性刺激,如温度、光照、磁场、电场等物理信号。通过构建剌激响应性的智能纳米药物载体,可以有效避免药物过早释放,大大降低了药物在运输过程中提前泄露而带来的毒副作用。
(5) 纳米药物载体可实现多功能化以及诊疗一体化。纳米粒子的量子效应、小尺寸效应和表面效应等基本物理效应一方面赋予了纳米载体独特的光热磁等特性,这使纳米载体本身可以作为疾病诊断探针。另一方面,纳米材料高的表面能和表面反应活性,使其可以作为药物控制释放载体的同时,又能够集多种功能性于一体,如下图所示。多功能性纳米粒子为癌症的治疗提供了新途径,同时实现对肿瘤组织的靶向、治疗、成像和不踪等作用,大大提尚了治疗的效率。
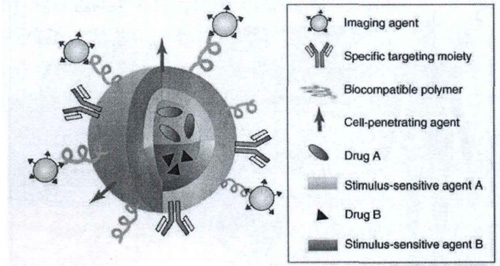
图 用于药物递送的多功能纳米颗粒
纳米药物载体种类
纳米技术的进步使纳米粒子成为靶向药物递送系统的有力候选者。纳米粒子通常是指直径约为10-1000nm的粒子,当被用作纳米药物载体时,可增加药物半衰期,提高对疏水性药物的溶解度并以受控或持续方式释放药物来改善药物的功效。刺激响应型纳米颗粒还可以帮助降低生物毒性并实现药物的可控释放。1964年,脂质体被用作药物和蛋白质的载体,是较早开发的纳米药物输送系统。自此之后,越来越多的材料被制成纳米颗粒并用作纳米药物递送系统。根据Bobo调查,在2016年,FDA批准了51种纳米颗粒,还有77种纳米产品正在临床试验中。
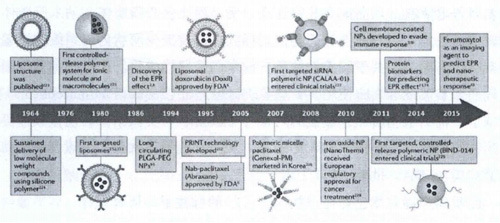
图 癌症纳米医学领域主要的发展历史
纳米药物载体的种类相当广泛,按照纳米材料的属性可分为无机纳米载体,如介孔二氧化硅纳米材料、碳纳米材料等;有机纳米载体,如脂质体、聚乳酸、壳聚糖,树状高分子等和金属纳米载体,如金纳米颗粒、银纳米颗粒等。下图列出了几种较为常见的纳米药物载体,现分别介绍如下
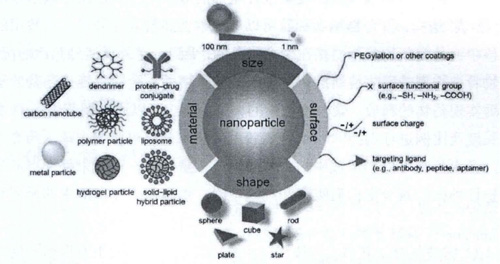
图 用于药物递送的纳米材料及其功能化修饰
(1) 脂质体纳米药物载体:利用磷脂双分子层膜所形成的纳米级囊泡包裹药物分子而形成的药物载体。由于磷脂分子具有一个亲水的头部和一个疏水的尾部,在形成脂质体时,亲水的头部位于双分子层的外面,而疏水的尾部则朝向双分子层的中间。这种特殊的结构可同时负载脂溶性药物和水溶性药物,其中脂溶性药物可负载于脂双层中,而水溶性药物则负载在颗粒内部。由于其脂双层结构类似生物膜且磷脂细胞自身具有较好的亲和性,所以脂质体有良好的生物相容性,生物体免疫反应较小。同时脂质体膜表面修饰方法众多,可根据需要在脂质体表面接枝理想的帮向性分子或者调节脂质体的表面带电情况,从而提高药物递送效率。相比普通脂质体,纳米脂质体在包封率、稳定性、靶向性、药物控制释放性以及减少网状内皮系统的吞噬方面有明显的提高。关于脂质体的研宄技术已经日趋成熟,现今己有多种脂质体载药体系被批准临床使用。塞奎斯制药公司(Sequus Pharmaceuticals)研制了一种纳米脂质体包裹盐酸阿霉素(Doxil),实验结果表明该载体可提髙药物的稳定性,延长药物释放时间,己于1995年首次获得美国食品药品监督管理局(FDA)批准上市。
脂质体药物载体在高压微射流均质技术推广之前,因为粒径控制问题也存在一些缺点:1.静脉注射脂质体载体,容易被网状内皮系统清除;2.脂质体在血流中很不稳定,会发生解组装,造成药物的提前释放。目前上市的产品大多经过磷脂修饰+高压微射流技术制备获得,粒径控制更精致,安全性已获得广泛验证。
(2) 聚合物胶束药物载体:是一些天然的聚合物如壳聚糖葡聚糖等,或者是人工合成的聚合物如聚乳酸(PLA)、聚乳酸一羟基乙酸共聚物(PLGA)等,它们通过团聚成微纳尺寸的颗粒来负载药物分子。聚合物纳米颗粒一般由两亲性聚合物构成,通过自组装形成胶束作为纳米药物载体。主要由具有亲水性头部及疏水性尾部的双亲性分子在水溶液中自组装形成“核-壳”结构。聚合物纳米颗粒可以将疏水性药物非共价包埋在胶束的疏水内核中或是将药物共价连接在聚合物上,在受到一定外界信号刺激的况下,聚合物骨架构型的变化使得胶束解体或是诱导切断聚合物上连接药物分子的连接臂实现药物的释放。聚合物胶束的大小、形貌可以通过调节亲水/疏水片段的长度及比例进行调控聚合物胶束的疏水内核可以增大疏水药物的溶解性,亲水外壳可以和溶液中的水分子形成大量氢键,在胶束外部形成紧致的保护性外壳,减少蛋白质吸附和细胞粘附,增强胶束在血液中的循还时间。
(3) 树枝状分子载体:树枝状分子是由己知形状、大小及保留有纳米粒子物理化学性质的蛋白质通过化学合成的一种具有多厚级结构的有机大分子。它的内核有一些亚纳米级的孔洞可用来负载药物分子,它的表面像树枝一样伸出多种功能基团,如胺基、羧基等,既保证了树枝状分子在水中的稳定性,又可用于修饰多种靶向性分子和显影分子,甚至是药物分子。树枝状大分子可以由多肽、脂质、多糖及其他合成物质制成用树枝状大分子进行药物运输可以提高药物的药物动力学,并能够瞄准标记组织控制药物释放。同时由于树枝状分子极小的尺寸(<5nm),可经由血管,从肾脏排出体外,具有极低的生理毒性。但是,复杂的设计与合成工艺,以及高昂的成本是树枝状分子难以在临床应用的主要原因
综上,有机药物载体是一些有机分子通过自组装过程形成的脂质体、多聚体胶束颗粒,或者是设计制备的树枝状分子、聚合物颗粒。这些有机载体设计原理简单,通过自身的形变或降解实现对负载药物的控制释放。但是有机纳米粒子在生物体内稳定性较差,且易被网状内皮系统清除,自身有机分子成分产生的毒副作用大,有机体分子量、尺寸不易控制,药物释放动力学不稳定等缺点大大限制了其应用范围。
与有机纳米粒子相比较,无机纳米粒子由于其尺寸均一可控、稳定性好、比表面积大、易于表面功能化,同时无机纳米粒子自身具有的独特光热、电磁等性质,可赋予其潜在的协同治疗和靶向示踪成像等功能。因此,无机材料如二氧化硅、碳材料、金纳米颗粒等在纳米载药系统中的应用得到广泛的关注和重视但是对于无机载体,一方面是载体自身的降解性能有待改善,进一步降低生物毒性。另一方面,需进行载体表面的修饰以实现良好的生物相容性也很重要,例如,修饰PEG可以提高无机纳米粒子在血液中的分散度、稳定性,延长粒子血液循环时间,促进其通过EPR效应进入肿瘤组织;或者修饰靶向分子促进无机纳米粒子特异性、高效地进入肿瘤细胞等。
有机纳米药物递送系统的制备目前国际上使用较多的是微射流高压均质设备,更多相关详情请参考
微流纳米Vic