针对难转染细胞的基因递送,新加坡国立大学学者利用微细胞囊泡技术(mCVT)首次制造出了一种嵌合基因递送系统,该研究利用了美国Genizer公司的脂质体挤出仪,并将成果见刊于Nanoscale杂志上。原文全名为:Micro cell vesicle technology (mCVT): a novel hybrid system of gene delivery for hard-to-transfect (HTT) cells. DOI https://doi.org/10.1039/D0NR03784B
关键词:类细胞微囊泡、基因递送、细胞转染、难转染细胞的新型基因递送技术。
新加坡国立大学研究团队在本研究中,介绍了一种新型的基于微细胞囊泡技术 ( micro Cell Vesicle Technology mCVT)的嵌合型基因递送平台系统。这种基因递送平台系统由细胞膜和阳离子脂质融合而成,被用于提高难转染(hard-to-transfect HTT)细胞的转染效率。微细胞囊泡的细胞膜成分赋予整个复合体胞吞特异性,减少了转染过程中的复合体细胞毒性,而阳离子脂质负责与遗传物质相结合,同时为mCVTs提供了结构完整性。
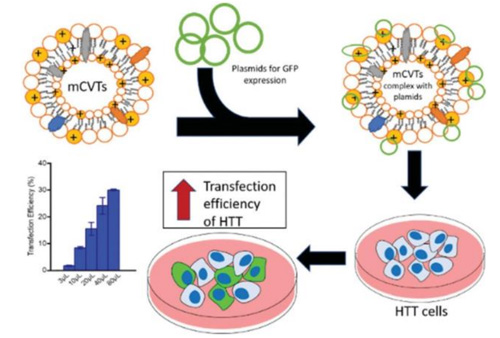
图1 利用类细胞微囊泡技术进行难转染细胞的转染过程示意
背景
基因递送是将外来DNA引入真核细胞的过程。如在基础研究(如药物发现和功能蛋白的机理研究)和临床应用(如基因治疗)中传递治疗性或功能性基因以改变细胞过程。有效的基因转染不仅需要成功地将外来核酸引入细胞,而且还需要它们随后在细胞中的转运和表达。这是一项具有挑战性的任务,因为DNA分子本身是带负电荷,因此在其常规形式下很难被细胞内化。因此,人们对开发有效的基因传递系统产生了极大的兴趣。在过去的几十年里,人们探索了大量的载体系统,从基于病毒的递送系统到非病毒载体。尽管非病毒基因递送载体的转染效率相对较低,但在安全性和临床接受度方面有望成为,其中阳离子脂质系统和基于聚合物的平台是主要的例子。表1总结了目前常用的转染试剂或方法的主要优缺点。
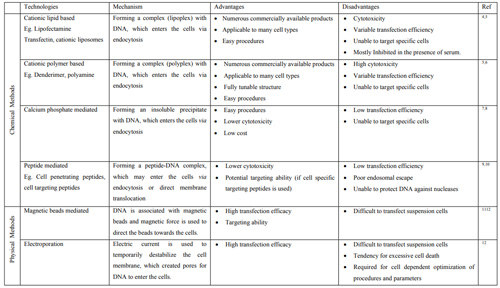
表1 目前主要转染试剂/方法的优缺点
理想的非病毒基因递送系统应能有效地将所需的DNA分子递送到特定的细胞类型中,且细胞毒性小至,以确保目标基因的大至表达。然而,据我们所知,目前市售的转染试剂明显达不到这些标准,特别是当它们被用于转染难转染(HTT)细胞时。
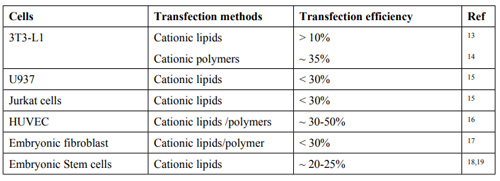
表2 常用转染试剂与方法对HTT细胞的转染效率
HTT细胞通常包括原代细胞、胚胎干细胞和一些永生化细胞系,如3T3-L1(小鼠前脂肪细胞)、U937(人单核细胞)、Jurkat(人T淋巴细胞)、HUVEC(人脐静脉内皮细胞)等。据统计使用市售试剂对HTT细胞进行质粒转染的效率经常不过25%。HTT细胞对外来物质和质粒的吸收率低的原因之一是其代谢活性低。此外,这些细胞通常对所使用的转染试剂引起的细胞扰动非常敏感,有可能导致细胞毒性,较终导致细胞死亡。
较近,鉴于细胞来源的递送系统有可能在一定程度上特异性地将活性货物分子递送到目标部位,因此获得了相当的关注。事实上,许多研究已经探索了使用单核细胞衍生的药物递送系统(DDS)来定向递送化疗药物和质粒DNA(pDNA)到肿瘤,或者使用红细胞衍生的DDS来延长血液循环和定向递送pDNA到血细胞中。据推测,保留母体细胞的细胞膜成分将赋予这些基于细胞的药物递送系统识别特定目标细胞的能力,可能通过逃避身体免疫系统的识别能力来促进。
尽管有重大的治疗意义,但迄今为止,基于细胞的DDS在基因传递方面的全部潜力在很大程度上仍未得到开发。需要解决的关键挑战包括细胞来源的DDS(如外泌体形式)的繁琐和低通量分离/生产过程以及次优的基因装载/复合技术。因此,虽然这些系统在内在的靶向性方面似乎很有优势,但它们在产量和pDNA装载效率方面有很大的局限。因此,为了克服这些限制,我们在此提出开发一种新型的嵌合基因递送系统,该系统由细胞膜成分和阳离子脂质成分组成,前者用于增强靶细胞的内化,后者用于增强pDNA的装载。
在这项研究中,我们首次描述了微细胞囊泡技术(mCVTs)的发展,这是一种通过阳离子脂质与细胞膜融合而获得的新型混合递送平台。为了生产mCVTs,首先用低渗水溶液处理细胞来获得鬼影细胞(CG无细胞质于细胞器细胞),如Goh等人所描述的。低渗溶液在质膜上形成短暂的开口,允许清除细胞内的内容物,同时保持质膜的完整性。来自不同细胞悬浮在水介质中的CG被用来水化干燥的DOTAP脂质薄膜,随后通过脂质体挤出仪挤出,提供与挤出的DOTAP脂质体相似的平均流体力学尺寸和Zeta电位的mCVTs。在这项研究中,我们证明了mCVTs能够与质粒复合并被目标细胞内化,而且细胞毒性小至。有趣的是,当从不同细胞类型产生的mCVTs在体外进行比较时,对于mCVTs所来源的细胞类型,它们显示出明显更高的转染效率。
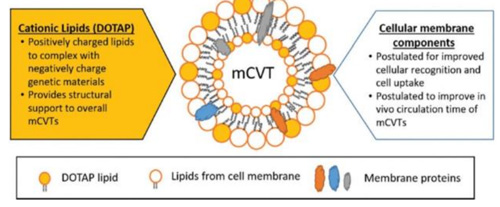
图2 mCVTs及其结构组件的示意图
方法与结果
制备鬼影细胞(CG无细胞质与细胞器细胞膜)以确保mCVTs的可重复性和安全状况。方法与结果 略
mCVTs的生产和特征分析。
与脂质体生产类似,脂质薄膜法被用来生产mCVTs。DOTAP薄膜与CG水合,形成包裹CG的大型多分子脂质体。这种悬浮液被挤出,来自CG的浆膜含有DOTAP脂质(如图3A所示)。按照我们小组以前建立的方法,证明在挤压后,这样产生的mCVTs由脂质和CG膜的融合组成。一般来说,mCVT的大小分布与脂质体相似。为了证明这种方法在各种细胞系中的稳健性和通用性,使用来自不同细胞系的CG制作了mCVTs,如一些HTT细胞(即3T3-L1)和非癌细胞(即HEK293和RAW264.7)。如图3B所示,各种mCVTs的流体力学尺寸和PDI通常在400纳米的范围内(PDI∼0.4),与使用相同挤压方法生产的DOTAP脂质体(PDI∼0.2)类似。在图3C中,不同的配方观察到类似的zeta电位值(约+30 mV至+40 mV),表明这种方法普遍适用于从不同细胞系产生的CG。有趣的是,当mCVT3T3-L1与pDNA复配时,其大小分布与未复配的mCVTs相似,而整体zeta电位变为负值,这可能表明复配成功(因为带负电的pDNA使带正电的mCVTs中和)。
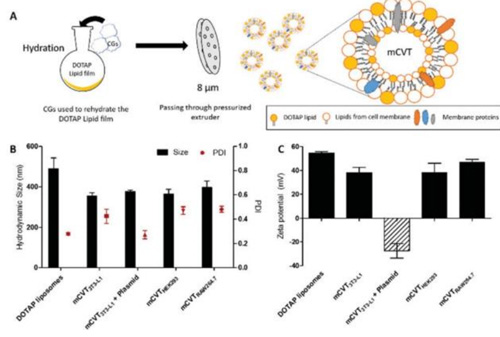
图3 mCVTs的生产和表征
A. mCVTs的示意图,涉及细胞鬼魂和水合薄膜制成的脂质体的融合。B. 不同的mCVTs和带有质粒的mCVT3T3-L1的水动力尺寸与DOTAP脂质体相比。所有mCVTs的尺寸都小于500纳米。C. 与DOTAP脂质体相比,不同的mCVTs和带质粒的mCVT3T3-L1的Zeta电位。所有mCVTs的Zeta电位都在+30 mV以上,除了带有质粒DNA(5 µg)的mCVT3T3-L1,由于与质粒DNA的相互作用而显示出负的Zeta电位。数据代表平均值 ± SD(n = 3)。

图 原文中mCVTs制备与所用脂质体挤出器描述
微流纳米Vic