大多数植物性分离蛋白,由于加工过程中的高热、高压处理,都含有大量的变性蛋白,从而对其再利用产生有害影响。对其进行改性预处理,打开卷曲缠绕的蛋白质折叠结构,成为其实际应用的必要处理步骤,多种技术如声、高压等得到应用,以改善蛋白质功能性质。
但对蛋白质进行预处理以利于短肽制备的研究还较少,研究发现采用声预处理可改善玉米蛋白的酶解性,增加底物与酶接触的机会,酶解液具有更窄的分子量分布范围,能够促进分子量 200~1000Da 肽段的形成。也有报道采用挤压技术处理玉米蛋白,提了酶解产物的 DPPH、ABTS 清除率等抗氧化活性,并鉴定获得了一个抗氧化六肽。
高压微射流(HPM)处理目前已经成为提高蛋白质功能性质的一种有效方法, 主要集中于蛋白质的乳化性、溶解性和凝胶性改良,大豆分离蛋白中应用较为广泛。大量的研究 证明 HPM 处理能够打开蛋白质结构,改变蛋白质表面疏水性,因此,采用 HPM 处理以改性蛋白质将有利于短肽制备。[1]
本文以花生冷榨制油后获得的花生蛋白粉为原料,采用碱溶酸沉法制备获得花生分离蛋白(PPI)后进行 HPM 处理,期望通过改性 PPI,促进 PPI 解聚,提高酶解得率,降低酶解成本;并且通过促进埋藏在蛋白质内部的疏水基团的展开,使酶能够进入到蛋白质分子结构内部,以增加酶用位点,特别是展开对疏水基团的攻击,提高获得高生理活性短肽的可能性,因为已有的研究已经证实,高疏水性往往与高 ACE 抑制活性相关联。
材料与方法
花生蛋白粉,山东高唐蓝山
氯化钠 分析纯 国药集团化学试剂有限公司
甘氨酸 分析纯 国药集团化学试剂有限公司
无水乙醇 分析纯 北京化学试剂公司
浓盐酸 分析纯 北京化学试剂公司
浓硫酸 分析纯 北京化学试剂公司
氢氧化钠 分析纯 北京化学试剂公司
磷酸氢二钠 分析纯 国药集团化学试剂有限公司
磷酸二氢钠 分析纯 国药集团化学试剂有限公司
8-苯胺基-1-萘磺酸铵盐(ANS) 色谱纯 美国 Sigma 公司
Tris 纯 美国 Sigma 公司
β-巯基乙醇 纯 美国 Sigma 公司
实验仪器
NanoDeBEE 微射流高压均质机 苏州微流纳米
LXJ-ⅡB 低速大容量离心机
DK-S28 电热恒温水浴锅
3K15 高速冷冻离心机
FE20 pH 计
101A-2B 电热鼓风干燥箱
HZQ-F160 恒温振荡培养箱
RE-52AA 旋转蒸发器
CPA225D 电子天平
UV-1201 紫外分光光度计
Foss-2300 凯氏自动定氮仪
F-2500 紫外可见荧光分光光度计
MOS-500 圆二色谱仪
H-7500 透射电子显微镜
十八角度激光光散射凝胶色谱系统
Zeta 电位仪
傅里叶变换红外光谱仪

实验方法:
微射流高压均质处理试验设计
(1)样品浓度对氮溶指数和表面疏水性的影响
分别配制浓度为 2%、4%、6%、8%、10%的 PPI 溶液,取高压微射流处理压力 100MPa,循环次数 1 次,通过微射流高压均质机后,分别收集处理后溶液,干燥;测定氮溶指数和表面疏水性,确定适宜的样品浓度。
(2)压力对氮溶指数和表面疏水性的影响
配制浓度为 5%的 PPI 溶液,分别在 30MPa、60MPa、90MPa、120MPa、150MPa、180MPa、210MPa 压力下通过微射流高压均质机,循环次数 1 次,分别收集处理后溶液,干燥;测定氮溶指数和表面疏水性,确定适宜的处理压力。
(3)循环次数对对氮溶指数和表面疏水性的影响
配制浓度为 5%的 PPI 溶液,在 100MPa 压力下通过微射流高压均质机,循环次数分别为 1、2、3、4、5 次,分别收集处理后溶液,干燥;测定氮溶指数和表面疏水性,确定适宜的循环次数。
数据处理及相关性分析
所有测试操作均重复三次。数据均用平均值及标准差表示,数据之间的显著性差异检测采用邓肯多重检验法使用 SAS 9.2 软件进行统计分析,取 p<0.05。测定获得的数据采用 Origin 8.0 作 图。
结果与分析
不同压力处理的花生分离蛋白在水分散系中水力学直径变化
水力学直径是蛋白质在水分散系中状态的重要表征。经不同压力处理高压微射流处理制备的PPI,可以看出,随着压力增加,水力学直径呈显著下降,对照为 202.8±2.3nm,而 210MPa 处理降低至 146.1±1.5nm (表 1),即使经过较低 30MPa 压力处理,其水力学直径也显著低于对照(p<0.05)。值得注意的是,120MPa 成为一个重要的转折点,处理压力低于120MPa 时 z-均粒径显著下降(p<0.05);而高于 120MPa 处理并没有造成 z-均粒径的持续下降,反而有所上升,但与 120MPa 处理并没有显著差异。从图 2 也可以看出,压力到达 210MPa 时,其 z-均粒径分布也与 30MPa、60MPa 低压处理接近一致,表明 210MPa 高压处理可能具有低压时相似的结构。
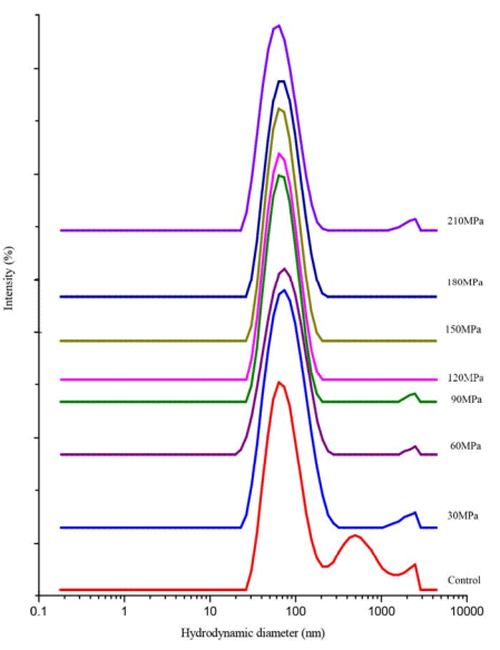
图2 微射流均质机 不同压力处理花生分离蛋白溶液粒径分布
PPI 溶液经高压微射流不同压力处理的多分散指数(PDI)呈显著的先下降后上升趋势,120MPa 同样是分界压力(表 1)。低 PDI 值指示了粒径分布趋于集中,高压微射流处理压力低于 120MPa 时,持续下降的 PDI 表明蛋白质粒子分布趋向一致,蛋白质发生了解聚或者破裂。过 120MPa 后,PDI 增加说明粒径分布趋向分散,蛋白质颗粒趋向聚集。

表 1 HPM不同压力处理的花生分离蛋白水力学直径和多分散指数
不同压力处理的花生分离蛋白分子量分布变化
蛋白质分子经高压微射流处理,剧烈的涡旋和剪切效应,会导致结构破裂。因而,分子量分布(MWD)可以反应出蛋白质分子结构的破裂程度。图 3 为花生分离蛋白经不同高压微射流不同压力处理的洗脱图,从图上可以看出,花生分离蛋白主要出现 3 个洗脱峰:18.9-20.9min(峰 1)、20.3-22.3 min(峰 2)和 21.9-24.6 min(峰 3)。这 3 个洗脱峰分别代表 2 个不同的分子量段:高分子量(HMW)、中分子量(MMW)和低分子量(LMW)。
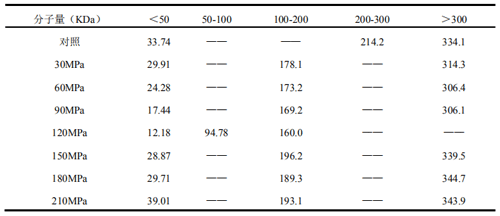
表2 高压微射流不同压力处理的花生分离蛋白分子量峰值
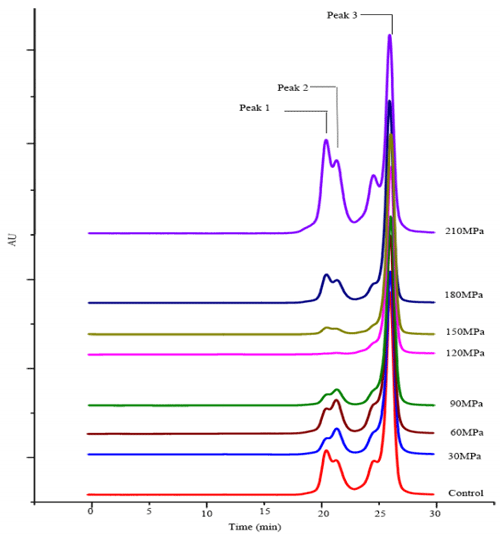
图 3 微射流高压均质机 不同压力处理花生分离蛋白溶液洗脱谱图
经高压微射流处理的花生分离蛋白分子量峰值随压力增加出现较大变化,如表 2 所示,分子量可以划分为 3 部分:<100KDa、<300KDa 和>300KDa,分别对应 LMW、MMW 和 HMW。与 z-均粒径和 PDI 变化相同,120MPa 再次成为分界压力。当高压微射流处理压力低于 120MPa时,3 部分的峰值都逐渐下降。而当压力大于 120MPa 时,3 部分的峰值都有所上升,但 150、180、210MPa 处理之间,差别不大,表明此时蛋白质结构趋于稳定。与 120MPa 对比,高于 120MPa处理明显具有更高的分子量。
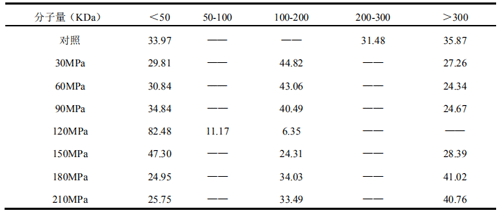
表 3 高压微射流均质机不同压力处理的花生分离蛋白分子量分布
对于分子量分布的分析也得到了与分子量峰值相同的结果。表 3中,随压力上升,HMW和 MMW 的相对比例也逐渐下降,而 LMW 的相对比例则逐渐上升。当压力为 120MPa 时,HMW的相对比例降为 0,而 MMW 和 LMW 的相对比例达到大至(分别为 6.35%和 93.65%)。而当处理压力高于120MPa 时,HMW 和 MMW 的相对比例又逐渐升高,而 LWM 的比例开始下降。因此可以认为,高压微射流处理压力高于 120MPa 时花生分离蛋白出现聚集,而低于此压力时,蛋白质表现为明显的解聚现象。
花生分离蛋白解聚与聚集过程的氢键变化
花生分离蛋白的圆二色谱分析见图 5,可以发现其在 192nm 处有一个正吸收峰,在 208nm处有一个负吸收峰,表明存在 α-螺旋结构。而在 196nm 处的正吸收峰和 215nm 处的负吸收峰则是 β-折叠结构的特征吸收峰。如表 4 所示,采用 CDpro 软件分析的对照蛋白的 α-螺旋和 β-折叠结构的比例大致相等。
HPM不同压力处理的花生分离蛋白在二级结构组成比例上存在较大差异(表4),以120MPa为分界点,形成了两个不同的变化趋势。处理压力为 120MPa 以下时,与对照相比,α-螺旋结构的比例随压力增加而下降,同时,β-折叠结构的比例则随压力增加而上升。当压力>120 MPa 时,α-螺旋结构的比例显著增加(p<0.05,与 120MPa 对比),而 β-折叠结构的相对比例则下降。另一方面,β-转角和无规则卷曲在试验压力范围内变化不大。有研究表明氢键易于打断或形成,因而,β-折叠结构的增加可能正是分子内氢键打断的结果,而分子内氢键的断裂也会导致蛋白质结构的展开。
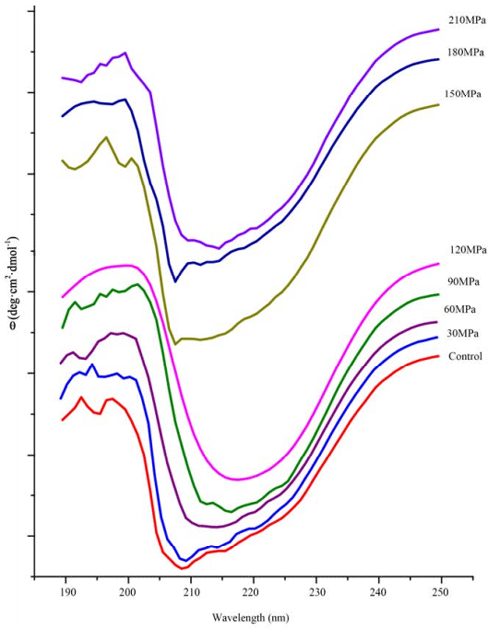
图 4 微射流高压均质机 不同压力处理花生分离蛋白溶液圆二色谱图
α-螺旋结构对于蛋白质分子结构的稳定性具有重要作用,而α-螺旋结构主要为氢键结构。α-螺旋结构下降(表 4)表明花生分离蛋白的氢键在 HPM 处理下极易打断。当然,这种打断总是有限度的,在 120MPa 时 α-螺旋结构达到较低值,压力继续增大对于 α-螺旋结构不会再产生较大影响。
研究曾经报道采用声诱导黑豆分离蛋白聚集,聚集体比未经声诱导蛋白含有更多的 β-折叠结构和较少的 α-螺旋结构。研究人员也发现微射流处理诱导的 β-乳球蛋白的变性或聚集过程中会形成 β-折叠结构。本实验聚集部分的结果与上述研究相吻合,但是如表 4 所示,与对照相比,聚集和解聚过程都伴随着 β-折叠结构的增加和 α-螺旋结构的下降,这表明 β-折叠结构的增加并不表示一定发生聚集。因而,不管是分子内氢键还是分子间氢键,都不是决定花生分离蛋白解聚或聚集的主要因素。
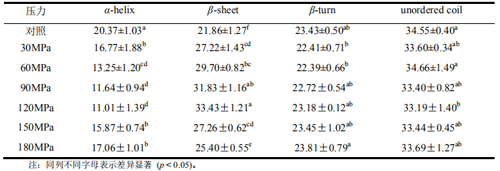
表4 高压微射流不同压力处理的花生分离蛋白二级结构
花生分离蛋白解聚与聚集过程的表面疏水性变化
蛋白质表面疏水性(H0)是暴露于表面的疏水基团数量的指针。HPM 处理的花生分离蛋白的表面疏水性随压力增加而上升(图 5)。持续升高的压力和随之产生的温度升高促进了之前埋藏在蛋白质内部的疏水基团的展开,这表明经 HPM 处理的蛋白质比对照拥有更多的展开片段,随压力增加而持续增加的表面疏水性与蛋白质在不同压力下所呈现的解聚及聚集变化并不吻合,这表明表面疏水性并不是造成解聚/聚集的重要因子,疏水相互作用也并不是蛋白质解聚或聚集的驱动力,随压力增加持续打开的蛋白质结构只是为蛋白质的解聚或聚集提供了必要的环境。
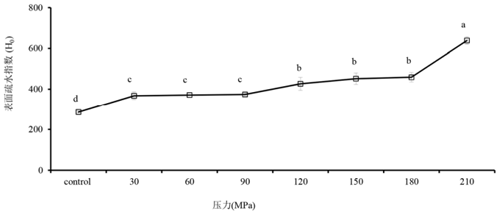
图 5 微射流高压均质机 不同压力处理花生分离蛋白表面疏水性
花生分离蛋白解聚与聚集过程的巯基-二硫键作用变化
巯基-二硫键交换反应(SH/SS)对于蛋白质聚集具有重要作用。如图 6 所示,压力变化显著地影响了总巯基和二硫键含量,随着 HPM 处理压力增加,SH 含量降低而 SS 含量增加。SS 表现了与表面疏水性相似的变化趋势,这表明持续暴露的疏水基团提高了 SS含量,从而导致 SH 含量下降。
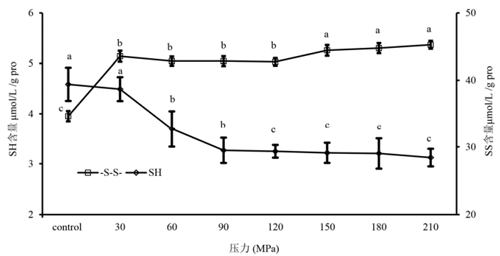
图 6 HPM 不同压力处理花生分离蛋白巯基和二硫键含量变化
分析 SH 和 SS 的变化可以发现,120MPa 以下压力时,60、90、120MPa 处理的 SS 含量之间无显著差异(p>0.05),SH 含量则显著下降(p<0.05),此时存在着花生分离蛋白解聚现象。当压力>120MPa 时, SS 含量与 120MPa 对比显著上升(p<0.05),而 SH 含量则变化不大,此时正处于聚集状态。本研究发现,SH/SS 链反应所导致巯基含量下降和二硫键含量上升在花生分离蛋白聚集状态下确实存在,但同样的变化也发生于花生分离蛋白解聚状态下。因而,可以判定 SH/SS 作用可能不是的造成聚集/解聚的驱动力,SH/SS 作用和其它因素一起可能影响了花生分离蛋白水溶液中的状态。
花生分离蛋白解聚与聚集过程的静电相互作用变化
Zeta 电位与悬浮颗粒的表面电荷密切相关, 图 7 表现了不同HPM 压力处理下的花生分离蛋白水溶液 zeta 电位变化,其变化趋势与分子量和分子量分布相似。处理压力为 120MPa 以下时,zeta 电位绝对值持续上升;当压力高于 120MPa 时,zeta 电位绝对值则下降,120MPa 成为表面电荷变化的分界点。Zeta 电位绝对值在压力≥150MPa 时下降表明分散系开始变得不稳定,而压力≤120 MPa 时,zeta 电位绝对值持续升高也意味着体系具有良好的稳定性。
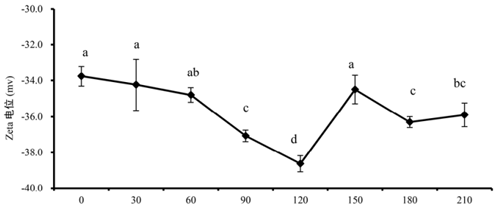
图7 高压微射流法 不同压力处理花生分离蛋白 zeta 电位变化
分散颗粒的表面电荷很大程度上影响体系分散性和聚集性。高电荷值(绝对值)表明粒子携带同种电荷多,粒子间静电斥力大,表征这分散胶体的稳定性,而低的电荷值则意味着分散系趋向凝聚或聚集。压力高于120MPa时,zeta电位绝对值的下降表明花生分开蛋白分散系静电斥力下降,因而体系趋向聚集。而当压力低于120MPa时,高的电荷绝对值意味着体系具有强的静电斥力,这种静电斥力克服了相互吸引的作用力(如范德华力、疏水相互作用等),导致蛋白质解聚,从而形成稳定的分散体系。
需要注意的是,有报道认为zeta电位绝对值>30意味着体系都具有较好的稳定性。本研究中的不同压力处理其电位绝对值都过30,也就是说,HPM处理制备获得的花生分离蛋白不管何种压力甚至对照都具有较好的稳定性,这表明zeta电位的改变仅仅提供了解聚和聚集的可能性,静电斥力并不是花生分离蛋白聚集或解聚的驱动力。
HPM 处理诱导花生分离蛋白解聚与聚集的机制
蛋白质分子构象始终处于介稳定状态。HPM处理包含了空穴、剪切和挤压等多种作用力,能够直接造成大分子结构改变。本研究获得的实验结果表明HPM处理能够打开或打断蛋白质折叠结构,其表征参数为表面疏水指数上升(图5),从而分子内氢键(表5)和巯基基团(图6)出现变化,二硫键含量(图6)、分子间氢键(表5)和ζ电位(图7)随之改变。通常情况下,疏水相互作用、分子间氢键和二硫键形成促进分散系去向聚集,而静电斥力增加导致解聚,但在本研究中单一驱动力并不能决定分散系的解聚或聚集。
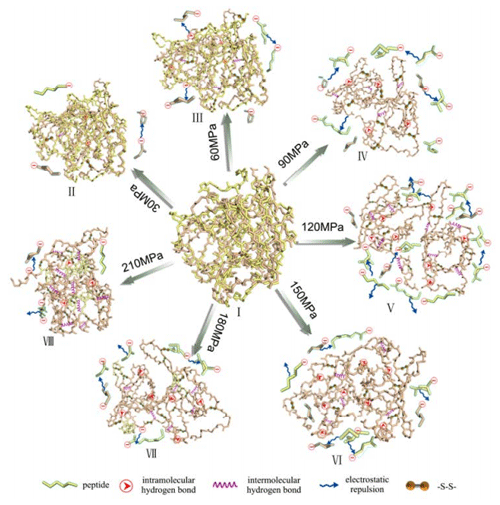
图 8 微射流高压均质机 处理诱导花生分离蛋白解聚与聚集动态模型
一般认为,低压只能引起有限的断裂。蛋白质低程度的断裂只能暴露少量埋藏在内部的基团,二硫键、分子间氢键和疏水相互作用也随之会有小幅度的增加;而持续增加的静电斥力起到了更大的支配作用,造成了更易于分散的环境,上述驱动力的作用叠加造成了花生分离蛋白结构的解聚。当压力到达120 MPa时,蛋白质展开程度进一步加大,埋藏的基团持续暴露于水性介质中,这时达到了大至的解聚程度。当压力过120 MPa时,压力进一步升高产生了更多的断裂蛋白质片段,这导致暴露基团相互之间作用的可能性增大。由于相互碰撞,一些片段形成了共价连接、分子间氢键或疏水相互作用,从而出现有限聚集。这种有限聚集埋藏了一些功能基团,导致静电斥力下降,引起聚集驱动力占据优势,聚集开始发生,小的聚集不断联接,较终形成大的聚集体。以上述推断为基础,本研究提出了花生分离蛋白经HPM处理诱导解聚与聚集的动态模型(图8)。
实验小结
1) HPM 处理可以获得物理改性花生分离蛋白,不同处理压力所获得的蛋白质具有不同的分散性。以 120MPa 为分界点,低压处理蛋白质在水分散系中解聚,而高压处理获得的蛋白质容易发生聚集。
2) 120MPa 时,蛋白质断裂片段之间相互碰撞的机会增多,促进了二硫键等共价键、氢键和疏水相互作用占据主导地位,蛋白质发生聚集作用。
3) 以 HPM 处理诱导蛋白质解聚及聚集理论研究结果为基础,使花生分离蛋白具有大至程度展开的适宜处理压力为 120MPa,在此压力下采用 HPM 处理物理改性花生分离蛋白可以提高酶解效率,并可能发掘更具 ACE 抑制活性短肽。
4) HPM 处理造成花生分离蛋白结构充分展开可以作为考察 HPM 工艺的依据,表面疏水性变化能够表征蛋白质结构展开程度,因此下一步 HPM 工艺参数考察,以表面疏水性变化作为考察指标。
苏州微流纳米Vic