RNAi简介
RNA干扰(RNA interference,RNAi)指RNA介导的转录后基因沉默现象,属于转录后基因表达调控一种。1998年两位美国科学家在线虫中发现双链RNA(double stranded RNA, dsRNA)导致了转录后基因表达沉默,因此于2006年获得诺贝尔奖。1998年以后在各种动植物中均发现RNAi现象,RNAi信号通路几乎出现于所有人体细胞中。该技术是通过导入与内源性mRNA编码区同源的双链RNA,通过切割成小干扰RNA(small interfering,siRNA)以引起特异基因mRNA降解,较终调控目的蛋白的表达水平。仅利用一段特异的小RNA片段,就可能轻松抑制任何基因的表达,这种RNA干扰技术被发现之后便被生物学领域广泛关注。对药物开发人员来说,siRNAs的效力和介导基因特异沉默的特性,使其有望成为“可编程”药物。
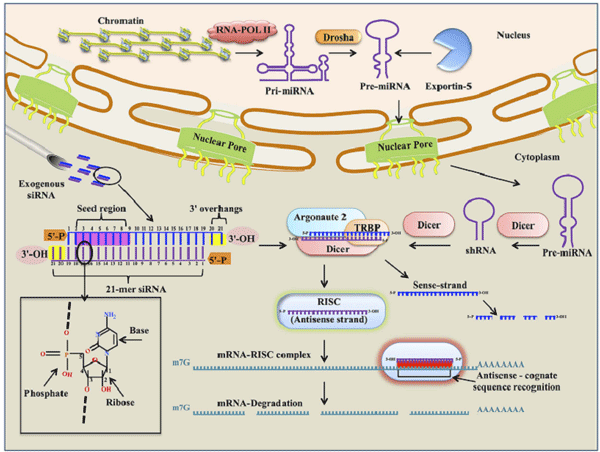
图. RNA干扰原理,siRNA分子结构以及细胞内作用方式示意图
siRNA载体系统
由于siRNA的临床研究中出现了免疫毒性、脱靶效应、不稳定等现象,使得siRNA的临床应用面临重重阻碍,大部分制药公司在2010年退出了RNAi药物研究领域。稳定发挥RNAi效应是siRNA走向临床应用的关键因素,一些制药公司与科研人员坚持对RNAi触发设计、序列优化、载体传递系统进行开拓与改进,其中包括脂质体、高分子聚合物、树枝状大分子、胶束、纳米微溶胶等等基于纳米材料的非病毒载体由于能在体内循环过程中稳定并保护siRNA,提高siRNA的转染效率、生物安全性及基因沉默效应,现已广泛用于siRNA的递送。同时,纳米载体可塑性高,可通过表面修饰或功能材料的加载赋予纳米载体更多的功能,大大提高非病毒纳米载体的应用价值。
脂质体纳米粒
无论是在体外还是体内环境,裸露的siRNA都面临着重重危险,因此寻找有效的纳米载体保护siRNA尤为关键。在上述众多纳米载体中,脂质体纳米粒(Lipid Nanoparticles,LNPs)是一种具有良好生物安全性和生物可降解性的新型药物载体,其类细胞膜的脂双层结构能同时包载亲水性和疏水性药物,有着许多无机纳米载体无可比拟的优势。
脂质体纳米粒应用举例
Emine , salva等采用LNPs共递送HIF-1α和VEGF siRNA以提高抗癌效率;Liyu Li等采用一种能与核仁素特异结合的适配子AS1411加载于LNPs的表面,赋予脂质体肿瘤靶向特性,用于治疗恶性黑色素瘤;Yusuke Sato等合成了一种新的pH敏感脂质YSK05,从而构造pH敏感型LNPs,旨在促进LNPs入胞后内涵体的逃逸。
随着脂质体研究的发展与进步,阳离子脂质体、长循环脂质体、 靶向脂质体、热敏脂质体、免疫脂质体、pH 敏感脂质体等各种多功能脂质体的研究广泛开展起来,为siRNA等稳定性差的基因药物提供了更好的保护。
美国上市首例siRNA药物
2018年8月10日,美国FDA批准Alnylam公司作用于肝脏的siRNA药物——ONPATTRO (patisiran),用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)引起的神经损伤。Patisiran是一种脂质体载体型药物,这是美国前列上市的RNAi药物。Patisiran的批准给hATTR患者带来了新的希望,让RNAi药物系统性递送到肝脏组织在临床上成为现实,也预示着RNAi治疗领域进入了新时代。