关键词: 熊果酸; 纳米制剂; 脂质体; 胶束; 纳米粒; 纳米悬浮剂; 纳米乳
本文将围绕熊果酸,低水溶性、低生物利用度药物之一,介绍通过脂质体等纳米载体制剂改善药物水溶性、提高药效以及作用时间的相关研究。
熊果酸( ursolic acid,UA) 是一种来自各种药用植物和水果中的五环三萜类化合物,其化学结构式如图1 所示。近年来,各项研究表明,熊果酸可以作为抗氧化剂、抗炎剂、抗菌剂、肝脏保护剂,还能抑制白血病细胞增殖并诱导细胞凋亡。该化合物通过多种途径抑制肿瘤细胞的分化、侵袭、转移和血管生成,对乳腺癌、肺癌、子宫内膜癌、前列腺癌和黑色素瘤等肿瘤的治疗效果显著。虽然熊果酸具有良好的抗肿瘤活性,但它水溶性差,口服给药体内吸收差,体外释放度小,体内半衰期短,生物利用度低,这些缺点限制了其在药学领域的广泛应用,影响其疗效的发挥。
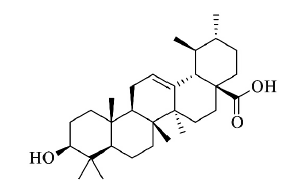
图1 熊果酸结构式
纳米药物递送系统( NDDS) 在药物递送等方面应用日益广泛,其可以显著延长药物作用时间、提高水溶性差的药物治疗性能和改善生物安全性。多种新型纳米载体,如脂质体、胶束和纳米粒等,可以通过增强的渗透性和保留( EPR) 效应更好地作用于肿瘤。基于NDDS 的广泛应用,多种熊果酸的新型纳米制剂相继被研发出来,如熊果酸脂质体、纳米粒等。本文就其现有研发的纳米制剂进行总结,讨论了各种纳米制剂的优势和不足,期望能够为其新型纳米制剂的研发及后续研究提供思路和参考。
1.脂质体
脂质体是一种常见的纳米制剂,其磷脂双分子层能够很好地包载疏水性药物,改善其水溶性,以下根据脂质体靶向进入作用部位的类型分别展开介绍。

图2 手动型脂质体挤出器
1) 被动靶向脂质体
一般脂质体可通过实体瘤的高通透性和滞留( EPR) 效应,被动靶向肿瘤细胞。Zhong 等实验室曾构建出熊果酸和拉米夫定以酰胺键和酯键连接的共聚物( LMX) ,具有抗肝炎病毒和保肝的双重效果。此次研究利用合成的LMX,采用薄膜水化法制备共聚物脂质体。所制备的脂质体分别经静脉注射和灌胃后,大鼠体内血浆药时曲线下面积( AUC0~ t) 和平均驻留时间( MRT0~ t) 较熊果酸溶液明显增加。静注给药后熊果酸生物利用度提高了1.35 倍,口服生物利用度是溶液的10.75 倍,在体内有效时间明显延长。此研究对脂质体分别进行静注和灌胃,不管是哪种给药途径,脂质体相对于溶液的相对生物利用度均有提高。脂质体在静注给药时,既可以避免胃肠道对药物非治疗作用的代谢,又能够减少疏水性药物溶剂的毒副作用,达到很好的治疗效果。体内药物代谢动力学试验很好地为熊果酸脂质体提高生物利用度、延长半衰期提供了有力的参考。
齐娜等根据熊果酸油水分布系数较大( lgP>0.5) 的特点,优化出处方工艺( 磷脂∶ 胆固醇= 2∶ 1) ,通过薄膜-声法成功制备了熊果酸脂质体。该脂质体体外释放过程符合一级速率方程,具有缓释特点。制备出的脂质体改善了熊果酸体外释放度低的缺点,为熊果酸脂质体的体内分布和药效等更深入的研究提供依据。脂质体药物的释放很大程度上受到其理化性质的影响,如类脂质材料的组成、脂质体表面的电荷等情况。脂质体结构在体内被代谢或者在体外被破坏后,包载的药物才会释放成游离药物,发挥药效。所以,根据脂质体的释放特点可以制备出在特定环境下释放,即具有靶向作用的脂质体。
2)主动靶向脂质体
添加具有某些靶向作用的材料,如:抗体、核酸、叶酸后,制备出的脂质体根据这些材料的靶向性而具有主动靶向作用。杨光等采用薄膜分散法制备了靶向叶酸受体的熊果酸长循环脂质体( F-PEG-L-UA) 。由于PEG 的修饰,该脂质体在小鼠体内实验中表现出明显的缓释特性和长循环效应。通过建立BALB/c 荷瘤裸鼠人口腔表皮样癌KB 肿瘤模型,实验表明该脂质体能够显著抑制肿瘤生长,有效延长荷瘤鼠的生存期,具有显著的抗肿瘤效果。并且,由于叶酸配体在肿瘤组织中的主动靶向作用,该脂质体対非靶向的组织和器官影响较小,能够有效减少药物的副作用,突显出主动靶向修饰的熊果酸脂质体应用于癌症治疗中增效减毒的潜在价值。

图3 气动型夹套温控式脂质体挤出器
3)环境响应性靶向脂质体
某些靶向脂质体的材料因为环境因素,例如pH 值、温度等因素而具有一定的靶向性。Rocha 等选用二油酰磷脂酰乙醇胺( DOPE) 、半琥珀酸胆固醇( CHEMS) 、二硬脂酸磷脂酰乙醇胺- 聚乙二醇2000( DSPE-PEG 2000) 等材料,通过脂质水合法制备UA 的长循环pH 敏感脂质体( SpHL-UA) 。此研究中,用pH 敏感性脂质体处理的动物,因为膜材在肿瘤酸性条件下分解,释放出UA,药物在肿瘤部位的摄取量约是游离药物处理的2倍,验证了药物在各组织分布的数据。该实验通过建模观察到UA 抗血管生成作用的实质证据: SpHL-UA 处理的动物模型中,血流动力学参数,例如组织血流量( FT) 、表面通透性( PS) 等,均明显降低。该研究首次评估了熊果酸脂质体的体内抗血管生成作用和靶向效果,在乳腺腺癌的治疗或胶质肉瘤的化学预防中具有启示意义。熊果酸脂质体的后续研究还有很多,所制备的脂质体承袭了脂质体给药系统的优势,改善了药物水溶性差的问题,提高生物利用度,达到缓释、增效减毒的目的,使其更好地应用于肿瘤预防和治疗。熊果酸药理活性广泛,脂质体的主动或被动靶向性均能很好的使其在靶向部位发挥疗效,使熊果酸的应用范围更加广阔。但是,脂质体不稳定,易氧化降解,重现性不易把握,这些缺点在一定程度上也限制了其临床实践。
2 胶束
胶束是聚合物自组装形成的一种纳米制剂,一般具有两亲性。现有的胶束根据其形成原理可分为嵌段型、接枝型、共价型和非共价键型等。关于熊果酸,其胶束研究的较少。Zhang 等通过缩合反应合成了细胞内pH 敏感的聚唾液酸-熊果酸聚合物( PSAU) ,为了进一步测试药物负载能力,实验者通过纳米沉淀法制备了载有紫杉醇的聚唾液酸-熊果酸两亲性共聚物胶束( PTX-loaded-PSAU) 。在该研究中,装载PTX 的PSAU 胶束在生理pH 下具有优异的稳定性,因为PSA 在肿瘤微酸性条件下易于水解,所以PSAU 能够在肿瘤部位释放负载的PTX。体外细胞毒性研究表明,PSAU 胶束对胃腺癌细胞( SGC- 7901) 几乎没有细胞毒性,而载有PTX 的胶束显示出高细胞毒性。在此研究中,熊果酸胶束不是作为独立的抗肿瘤药物起作用,而是作为一种材料,一种新型的药物递送系统,使传统的化疗药物更好地发挥作用。通过本试验,可以看出PSAU 胶束用于癌症化学疗法的药物递送系统的潜力,为熊果酸的胶束制剂应用开拓了一种新思路。
聚合物胶束作为常见的纳米制剂类型,在熊果酸的应用方面相比较其他纳米制剂类型却并不常见。因为胶束包载熊果酸的量较少,熊果酸在少量的情况下难以发挥预期效果。而且胶束的重现性和大规模生产的可能性较低,所以熊果酸的胶束研究还有待进一步探索。
3 纳米粒
纳米粒是目前较为常见的纳米制剂,将药物包载于各种高分子材料中制备成纳米级的颗粒。Zhang 等使用两亲性甲氧基聚( 乙二醇) -聚己内酯( mPEG-PCL) 嵌段共聚物作为药物载体,通过纳米沉淀法制备负载UA 的纳米颗粒( UA-NPs) 。UA-NPs 通过纳米粒的EPR 效应,将UA 有效转运到SGC-7901 细胞中。试验表明,UA-NPs 具有更高的细胞毒性,且与游离熊果酸处理过的细胞相比,其COX-2 和caspase-3 表达水平差异显著。UA-NPs 可以更强地抑制环氧化酶-2 ( COX-2) 和更多地激活细胞凋亡蛋白酶( caspase3) ,从而诱导更多的细胞凋亡。纳米粒一般通过胞吞作用进入细胞,UA-NPs 在穿透细胞膜方面明显优于游离UA,因此,纳米粒可以在细胞水平提高药效。该研究为通过纳米给药系统提高UA 在细胞水平的抗癌效率提供了有力证据,为后续实验研究提供了参考。
Alvarado 等用聚( dl-丙交酯-共-乙交酯) 酸( PLGA)和泊洛沙姆( P188) 采用溶剂置换法负载熊果酸和齐墩果酸( OA/UA-PLGA NPs) 。试验结果表明,该纳米粒6 个月储存稳定性良好,且包封的药物以稳定的速率释放,显著增加眼组织中有效药物的积聚,延长眼睛停留时间。针对兔子的眼部炎症,纳米制剂的抗炎效果显著增强。此研究制备的纳米粒侧重于使药物稳定有效地释放,延长作用时间,减少给药次数,体现了熊果酸纳米制剂的一大优势。
Zhao 等使用乳糖酸修饰、pH 敏感的壳聚糖-共轭介孔二氧化硅纳米复合物共同递送熊果酸和索拉非尼( USMNs-CL) 。该纳米粒可以提高肝癌细胞Huh-7、SMMC-7721 和HepG 2 细胞的摄取,增强细胞毒性,抑制癌细胞增殖、黏附、迁移和血管生成。人肝癌H22 细胞造模的荷瘤小鼠和肺转移模型小鼠的体内实验结果表明该纳米制剂能够明显抑制肝细胞癌( HCC) 的生长和转移,对HCC 的化学预防具有重要价值。此研究制备的纳米粒是一种包括熊果酸和索拉非尼两种药物的复合物,表明熊果酸可以和某些药物共同作用于肿瘤的治疗和预防,为熊果酸纳米粒的应用提供了一种新的可能。双药联用,既可以通过协同效应增强药效、降低用药剂量,又可以通过药理活性上的互补减小毒副作用,还可以延缓药物依赖性。针对两种不同的药物,纳米粒的递送一方面可以控制两种药物的剂量,使其以较简单有效的比例发挥预期效果; 另一方面可以有效减少两者在理化方面的相互作用,借助载体材料可以使药物都到达靶向部位发挥疗效。此外,纳米粒递送可以使药物达到预期效果的同时减小或者延缓药物依赖,改善甚至逆转肿瘤细胞耐药性,更好地发挥双药联用的优势。
Jiang 等设计并合成了基于介孔二氧化硅,叶酸靶向并用pH 敏感的壳聚糖修饰的熊果酸纳米粒( UA M-CS -FA) 。体外细胞试验表明UA M-CS-FA 抑制癌细胞生长,使细胞周期停滞在G0 /G1期,抑制癌细胞侵袭和迁移。体内实验进一步证实UA M-CS-FA 抑制荷瘤裸鼠的肿瘤进展和肺转移。UA M-CS-FA 的显著效果表明UA 在抗癌和预防癌症转移方面潜力巨大。熊果酸的靶向纳米粒同其他药物的靶向纳米粒一样,介孔二氧化硅纳米粒子( MSN) 介孔结构有序、体积小、生物相容性好,药物加载到MSN 中以控制药物输送; pH 敏感的壳聚糖修饰使其在肿瘤的酸性环境中更易释放; 叶酸靶向使其集中在叶酸受体较多的肿瘤部位,体现出纳米制剂靶向治疗癌症,减少毒副作用的优势。
Fan 等利用UA 分子间的相互作用开发了无载体纳米药物( UA NPs) 。简而言之,在剧烈搅拌下将UA/乙醇溶液缓慢倒入10 mL 水中,混合后声15 min,使UA 通过分子间疏水相互作用和氢键相互作用,自组装形成表面带负电荷的UA-NPs,较后干燥其中的有机溶剂,除去沉淀物,使其通过溶剂交换的方法制备。UA NPs 表现出更高的抗增殖活性,显著降低COX-2 /VEGFR2 /VEGFA 的表达,诱导细胞凋亡,并且提高TNF-α、IL-6 和IFN-β 的免疫应激活性。研究发现,UA NPs 可刺激CD4+ T 细胞的活化,这表明UA NPs 具有免疫治疗的潜力。由此可见,无载体的UA 纳米药物可能是一种充满前景的药物,可进一步增强其抗癌功效和免疫功能。同时,Zhao 等通过UA、LA 和ICG 自组装开发了一种新型无载体和共组装纳米药物UA-LA-ICG NP,用于靶向癌症成像和有效的化学光疗法。UA-LA-ICG NPs + NIR 处理组在H22 异种移植小鼠中显示出明显的抗肿瘤活性,表明这种新型纳米制剂在癌症成像和光化学疗法应用中前景广阔。
在后来的实验中,涌现出大量关于熊果酸纳米粒的研究。Zhang 等发现熊果酸的-COOH 和乙二醇壳聚糖胶束的-NH2 可以通过静电相互作用形成纳米粒( UA-GC) ,通过多种机制作用于肿瘤细胞,为骨肉瘤的治疗提供一个新的策略。邱琳等采用乳化溶剂蒸发法,制备了熊果酸纳米粒( UANs) 冻干粉,优化制备处方,筛选出较好工艺并考察其溶解度和溶出速率。Ahn 等在实验中应用一种简单的电泳法制备了叶酸偶联熊果酸纳米粒子( FA-UA) ,对人口腔表皮样癌细胞( KB) 效果更明显。Wang 等将金-熊果酸加载到聚( DL-丙交酯-共-乙交酯) 中制备纳米粒子。数据表明,与对照组相比,熊果酸纳米颗粒通过激活caspase 和p53,抑制抗凋亡相关信号,显著抑制了宫颈癌细胞的增殖,侵袭和迁移,诱导细胞凋亡。各种关于熊果酸纳米粒的制备和应用还有很多,大量的试验证明了纳米粒在熊果酸新型制剂中的重要作用和广阔前景。
熊果酸的纳米粒研究之所以火热,是因为纳米粒递送能够改善熊果酸的水溶性、提高生物利用度、延长半衰期。熊果酸对多种癌症均有治疗效果,以上多项研究表明,纳米递送的熊果酸能够在细胞水平提高其抗肿瘤效果,增强其靶向作用,还可以同其他抗肿瘤药物合用,增强疗效的同时减少毒副作用。但是,熊果酸纳米粒的应用相对单一,大部分都是应用于抗肿瘤,针对熊果酸的其他活性,比如抗氧化、抗炎等所涉较少。
4 纳米混悬剂
纳米混悬液是一种亚微级别的分散体系,将药物均匀分散在介质中。Wang 等使用流动多入口涡旋混合器( MIVM) ,将含有稳定剂[0.05%的聚乙烯吡咯烷酮( PVP)K90 和十二烷基硫酸钠( SDS) ]的水作为反溶剂相,含UA 的乙醇溶液作为溶剂相填充,通过反溶剂沉淀法制备熊果酸纳米混悬液,研究两种不同粒径大小的UA 纳米混悬液对MCF-7 细胞的毒性。结果表明,粒径为300 nm 的纳米悬浮液比100 nm 的表现出更高的抗增殖活性,且细胞凋亡更多集中在早期和晚期阶段,粒径可能是UA 纳米悬浮液抗肿瘤效果的关键决定因素。此研究在制备熊果酸悬浮液的基础上,通过抗增殖能力的不同筛选影响纳米悬浮液疗效的因素,为后续悬浮液的进一步研究奠定基础。
钦富华等以卡波姆940 为基质,采用反溶剂沉淀法制成熊果酸纳米混悬凝胶剂( UA-NS-gel) ,该制剂能够有效地增加熊果酸的皮肤渗透性能和皮肤的滞留量。结果显示,UA-NS-gel 的皮肤渗透量为普通凝胶剂UA-gel 的3.66 倍,皮肤滞留量是UA-gel 的1.96 倍。此研究突显出熊果酸悬浮凝胶剂良好的皮肤渗透性能,为其在创新给药方式方面创造可能性。
5 纳米乳
纳米乳是在表面活性剂作用下形成的乳剂,具有良好的生物相容性。Alvarado 等以蓖麻油作为油相,丙二醇为水相,辛酸甘油酯为表面活性剂,二乙二醇单乙醚为辅助表面活性剂制备熊果酸纳米乳。体内试验的结果表明,所开发的制剂无毒,对皮肤无刺激性,表现出更强的抗炎能力。该发现明确地证实了O/W 纳米乳剂对包括熊果酸在内的五环三萜类化合物在透皮吸收中具有重要价值,为其更广泛地发挥抗炎效果提供了一种新的制剂形式。Vargas de Oliveira 等以蒸馏水作为水相,丙二醇单辛酸酯( Capryol 90) 和聚氧乙烯蓖麻油( Cremophor EL) /二乙二醇单乙醚( Transcutol P) 作为油相,制备包载熊果酸的纳米乳。生物学研究表明,含有熊果酸的纳米乳剂是无毒的,且对寄生虫的复制形式有效。此研究表明,稳定且有效的纳米乳剂是用于治疗诸如南美锥虫病等威胁性疾病非常前途的新型制剂。熊果酸的纳米乳常应用于发挥其抗炎、抗菌作用。尤其针对皮肤炎症,纳米乳可以直接涂抹,通过透皮吸收发挥药效,方便快捷高效。熊果酸的纳米乳应用前景广阔,除却口服和注射这些常见的给药系统,还可以应用于皮肤给药,充分发挥其抗炎、抗菌的药理活性作用; 也可以用于眼部等黏膜组织给药,针对靶向部位直接作用。由此可见,熊果酸纳米乳是非常有潜力的纳米制剂,当然,也存在稳定性差,易集聚,重现性不易把握等缺点,有待进一步研究。
6 总结
熊果酸的药理活性广泛,为了改善其水溶性差,生物利用度低的问题,大量的纳米制剂应运而生。这些纳米制剂根据不同的目的而设计,有些为了增加疗效; 有些为了减少非靶向部位的蓄积从而减少毒副反应; 有些为了延长药物作用时间,使其缓慢有效地释放,但在一定程度上都是为了能够促进其更好地应用于临床。纳米制剂所具有的靶向能力,对熊果酸这类药理活性广泛,多靶点的药物,能够使其发挥预期的治疗作用,避免产生非治疗部位的毒副反应,治疗效果更为明确。目前研究的熊果酸纳米制剂都能很好地达到预期效果,但是基本都停留在研究室基础研究阶段。熊果酸的药理活性及其作用机制还在不断探索完善,相应的纳米制剂也在不断进步发展中,能够应用于临床实践中的纳米制剂还需进一步研究。[1]
苏州微流纳米Vic